### 原子的基本构造
1. 原子模型:

- 原子是物质的基本单位,由质子、中子和电子组成。质子和中子位于原子核内,电子则绕核外运动。
- 最早的原子模型是约翰·道尔顿的“不可分割的球体模型”,后来发展为卢瑟福的核模型和玻尔的量子理论模型。
2. 电子轨道:
- 根据量子力学,电子不是沿着固定轨道运动的,而是存在于特定的能级(轨道)中,这些能级由量子数描述。
- 电子轨道的数量和排布规律取决于原子的能级构造和元素的电子排布。
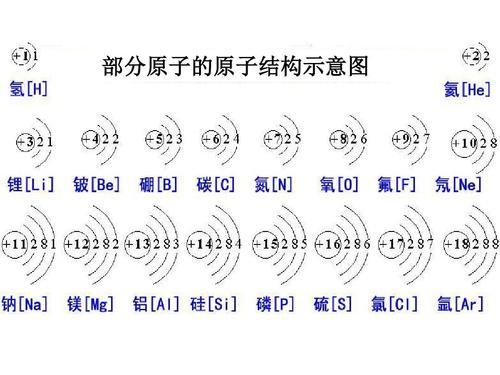
### 原子中的电子数量
1. 电子数与元素:
- 一个原子中的电子数量取决于其原子序数,也便是元素在周期表中的位置。每个元素的电子排布是有规律的。
- 氢原子(原子序数为1)只有一个电子,而氦原子(原子序数为2)有两个电子。
2. 元素的电子排布:
- 根据阿基米德事理和泡利不相容事理,每个电子能级最多容纳一定数量的电子,且电子必须添补到不同的能级中。
- 电子的添补顺序遵照能级从低到高、轨道内从内到外的规律。
### 电子排布的规律
1. 主能级和子能级:
- 原子的电子排布紧张涉及主能级和子能级的观点。主能级表示电子的紧张能量水平,而子能级则表示主能级内的不同轨道。
- 例如,第一主能级(K层)有1个子能级(1s轨道),第二主能级(L层)有2个子能级(2s和2p轨道)。
2. 添补顺序:
- 按照泡利不相容事理和洪特规则,电子添补顺序为1s² 2s² 2p⁶ 3s² 3p⁶等。每个子能级的最大添补电子数为2n²,个中n为主量子数。
- 例如,氧原子的电子排布为1s² 2s² 2p⁴,氮原子的电子排布为1s² 2s² 2p³。













